Résumé
La médecine ostéopathique crânienne est pratiquée dans le monde entier, dans le respect des affirmations du créateur, le Dr Sutherland. Bien que l’approche manuelle actuelle suive fidèlement les bases théoriques et pratiques qui composent le modèle crânien du siècle dernier, de nombreuses preuves scientifiques mettent en évidence les aspects critiques de ce modèle. Dans la première partie, nous avons passé en revue le rôle des méninges et du liquide céphalo-rachidien (LCR) et discuté de certains rythmes présents dans le système nerveux central ; ces derniers éléments sont les piliers utilisés pour soutenir l’idée théorique du mouvement du crâne palpé et évalué par l’ostéopathe. Dans cette seconde partie, nous passerons en revue les caractéristiques mécaniques des autres structures composant le système crânien, en mettant en évidence de nouvelles perspectives de pratique clinique, grâce aux données les plus récentes issues de la recherche scientifique.
Introduction et contexte
La médecine ostéopathique manipulatrice crânienne (OCMM) est née des intuitions d’un étudiant du Dr Still (fondateur de la médecine ostéopathique), le Dr Sutherland [1]. La logique de l’OCMM est basée sur le mécanisme respiratoire primaire (MRP), un modèle théorique construit sur cinq principes, illustrant les raisons du mouvement crânien ou du rythme crânien dans le domaine ostéopathique : la fluctuation du liquide céphalo-rachidien (LCR) ; la motilité inhérente du système nerveux central et de la moelle épinière ; la mobilité des membranes méningées (crâniennes et rachidiennes) ; la mobilité articulaire des os du crâne ; et le mouvement involontaire (passif) du sacrum entre les os iliaques [1]. La manipulation crânienne a été introduite comme pratique clinique du médecin ostéopathe en 1930, et elle est devenue un sujet d’étude universitaire en 1940 [2]. L’évaluation et le travail manuel sur le crâne ne signifient pas que le reste du corps n’est pas pris en compte, l’ostéopathie considérant le patient comme une unité aux relations anatomiques toujours interdépendantes [3]. Selon le Dr Viola Frymann, la palpation du rythme crânien est possible et ne dépend pas de la pulsation des vaisseaux artériels qui alimentent le cerveau ; le rythme Traube-Hering, souvent associé au rythme du crâne, ne représente pas en réalité le rythme palpé par l’ostéopathe [4]. Les valeurs enregistrées par le Dr Traube et le Dr Hering sont issues d’expériences animales avec le thorax ouvert et le muscle diaphragme paralysé [4]. Le rythme crânien peut également être palpé en plaçant les mains sur le reste du corps, en opposition avec les ondes Traube-Hering [5]. Il faut également considérer que la palpation humaine est très fine et capable de reconnaître de très petits objets, mesurant 10 nm ou 0,01 pm [6]. Cette capacité est dans la plage du mouvement des sutures crâniennes. Pour certains érudits, les sutures du crâne chez l’adulte, étant encore reconnaissables, ne fusionnent pas mais deviennent seulement très adhérentes ; de plus, les sutures entre les os qui forment le crâne peuvent présenter des mouvements de l’ordre de 500 à 1 700 nm ou 5 à 17 microns, palpables par l’homme [5]. Selon la vision ostéopathique, chaque os constituant du crâne se déplace avec ses propres axes et plans, faisant des sutures une articulation ; les modèles de mouvement ont été créés artificiellement et avec une base théorique afin d’obtenir des points de référence lors de la palpation [7]. Sutherland lui-même affirme que de tels schémas ne correspondent pas nécessairement à la réalité [8]. L’articulation qui représente le moteur du mouvement crânien et à laquelle sont attribués les différents dysfonctionnements imaginés par Sutherland, est la synchondrose entre l’os occipital et l’os sphénoïde, la synchondrose sphéno-basilaire (SSB), tant chez l’adulte que chez l’enfant [7]. La deuxième partie de l’article passera en revue le SSB et la fonction suturale du crâne, les caractéristiques mécaniques du cerveau, le mouvement de l’os sacré, en réfléchissant sur la nécessité d’un nouveau modèle ostéopathique crânien. Comme spécifié dans la première partie, l’article prend en considération les informations scientifiques du crâne adulte, en laissant de côté le crâne de l’enfant et des personnes âgées.
Mobilité articulaire des os du crâne
Le crâne adulte est composé de 29 os, en général, mais on ne sait pas toujours exactement combien il y a de sutures (environ 15). La littérature indique que la taille du crâne dépend de la croissance du cerveau, tandis que les sutures déterminent la forme [9]. À la surface de l’os lui-même, par exemple l’os pariétal, on peut trouver des sutures qui ne correspondent pas à la vision anatomique classique ; les sutures en plus grand nombre créent des os indépendants (os wormiens ou os incas), tels que des os pré-interpariétaux et interpariétaux, ou des os isolés trouvés sur un côté ou plusieurs os sur la suture principale (suture lambdoïde) [9], les os et les sutures en plus grand nombre dépendraient de centres d’ossification qui ne sont pas toujours pris en compte [10]. Les os wormiens et, par conséquent, des relations articulaires non linéaires, se trouveraient principalement sur la zone droite du crâne et impliqueraient pour environ 50 % la suture lambdoïde ; 25 % la suture coronale, tandis que le reste des os wormiens se trouve dans différentes zones du crâne [10]. Selon la population, les os wormiens seraient trouvés avec un pourcentage de 8 % -15 % dans les civilisations occidentales ; dans la population chinoise, l’excès d’os serait présent chez 80 % de la population [10]. Il n’y a pas d’accord sur l’existence de différences entre les sexes [10]. S’il y a présence de plus d’os, cela crée un possible tableau clinique pathologique (pycnodysostose, rachitisme, ostéogenèse imparfaite, et autres) [9-10]. Il peut y avoir d’autres types de sutures dans le crâne adulte, telles que les sutures mendosales ; ces dernières sont très courtes (de 0,8 mm à 1,4 cm), et proviennent de la partie médiale de la suture lambdoïde, vers l’os occipital [11]. La palpation évaluative du crâne (et des vertèbres) par l’ostéopathe doit avoir deux objectifs : vérifier position et mobilité [12]. Mais quelle est l’origine du rythme crânien décrit par Sutherland dans lequel les os du crâne bougent ? Ces questions sont fondamentales pour comprendre la réalité scientifique du travail ostéopathique. Dans la première partie de l’article, nous avons montré comment les membranes sont capables de transmettre les mouvements du cerveau induits par le rythme cardiaque et la respiration diaphragmatique, en ralentissant la fréquence, grâce aux caractéristiques méningées intrinsèques. Les sutures du crâne ou synarthroses, bien que présentant des caractéristiques différentes, sont capables de diminuer la fréquence des stimuli mécaniques qui les atteignent [13]. Plus la fréquence du stimulus mécanique est élevée, plus la valeur de la contrainte distribuée est faible [13]. Cette caractéristique coïncide avec notre observation du mécanisme respiratoire secondaire (MRS), dans laquelle les rythmes du crâne dépendent de l’activité cardiaque et respiratoire, bien que le rythme palpé par l’ostéopathe soit plus lent. Les sutures morphologiquement plus complexes sont capables de supporter une plus grande force mécanique [14]. Les sutures du crâne sont constituées de tissu fibreux avec deux couches d’ostéoblastes dont les dernières couches contiennent des cellules mésenchymateuses ; la couche supérieure est recouverte par le périoste, tandis que la couche inférieure est en contact avec la dure-mère [15]. Dans l’espace des cellules mésenchymateuses, nous trouvons le facteur de croissance nerveuse (FCN), qui permet au nerf présent dans la suture (nerf trijumeau de la dure-mère) de survivre et de fonctionner correctement [1,16]. Ces fibres nerveuses sont proprioceptives mais, en cas de blessure, elles peuvent devenir nociceptives [16]. De plus, le présent tissu nerveux est capable de réparer le tissu en cas de fracture ; la présence de cellules mésenchymateuses, et la présence de tissu nerveux capable de stimuler les processus réparateurs dans une suture aplatie du crâne, peuvent nous conduire à émettre l’hypothèse que les sutures crâniennes sont actives et participent aux stimuli mécano-métaboliques du corps. Lorsqu’il y a une structure dans le corps humain, c’est parce que la même structure est utilisée et possède un ou plusieurs buts ou fonctions. Les sutures craniofaciales restent partiellement ouvertes au stade adulte (elles ne s’ossifient pas), et chez le sujet âgé [1], les sutures telles que l’occipito-mastoïde et la pariéto-mastoïde restent non ossifiées jusqu’à l’âge de 80 ans ; le sphéno-pariétal et le sphéno-frontal restent non ossifiés jusqu’à l’âge de 60 ans (figure 7) [1].
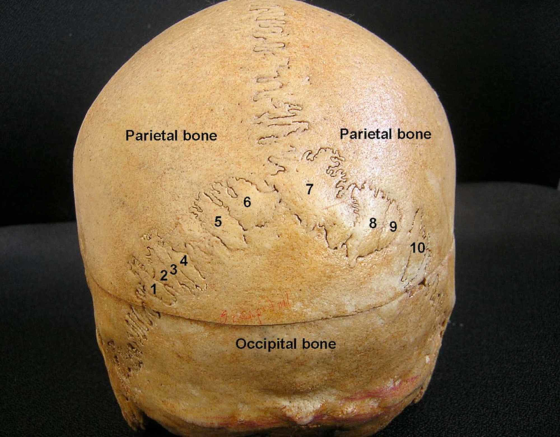
Figure 1 : Vue postérieure du crâne montrant 10 sutures osseuses (Os wormiens).Remerciements au Dr Satheesha Nayak B, professeur agrégé d’anatomie, Melaka Manipal Medical College (Campus Manipal), Centre international des sciences de la santé, Madhav Nagar, Manipal, district d’Udupi, État du Karnataka, Inde.
Des études existent montrant que les os du crâne peuvent bouger sous certains stimuli physiologiques, avec une moyenne d’environ 17 à 70 microns (valeurs plus élevées que les revues précédentes) [5, 17-18]. Probablement, non seulement les sutures permettent la transmission de forces dérivant du mouvement du système nerveux, mais également la structure de l’os du crâne lui-même. Les os qui composent le crâne ont des propriétés élastiques, l’os temporal ayant la capacité maximale de résister à la tension, jusqu’à l’os le moins souple tel que l’os frontal [19]. De plus, la dure-mère sous-jacente et le périoste, qui est un continuum avec le tissu sous-jacent à travers les fibres perforantes de Sharpey, collaborent à la gestion la plus correcte des signaux mécaniques [19]. Le tissu osseux contient de l’élastine et du collagène et, ensemble, ils assurent une capacité de déformation mécanique d’environ 10 à 15 %. L’os du crâne se comporte différemment des os du corps. Si les os du corps humain voient leurs capacités élastiques diminuer avec l’âge, les os du crâne ne subissent pas cette adaptation [20]. La structure intrinsèque des os crâniens, comme les os du corps, contient des ostéocytes, mais ces derniers se comportent différemment. L’ostéocyte qui dérive de l’ostéoblaste, constitue environ 90 % de l’os, est imprégné dans la matrice osseuse, et représente la pointe de l’équilibre de la santé du même tissu ; ils constituent un réseau de petits canaux (comme les cellules dendritiques), avec lesquels ils communiquent avec d’autres ostéocytes, ostéoblastes et ostéoclastes et tous les fluides contenus dans l’os [211. Si le nombre diminue, comme c’est le cas avec la vieillesse, l’os voit ses qualités plastiques et élastiques diminuer ; cet événement ne se produit pas dans les os du crâne, y compris la mandibule [21]. Les liquides osseux (sang et eau) sont également importants pour une distribution physiologique des signaux mécaniques entre l’extérieur et l’intérieur de l’os ; les fluides font vibrer l’ostéocyte par altérations métaboliques (variations calciques), permettant ainsi une adaptation tissulaire optimale [22]. Plus la force mécanique qui atteint l’os est faible (maximum 10 Hz), meilleures sont la réponse hydrique et la gestion de la tension [23]. Un autre aspect de l’OCMM est l’attribution d’axes et de plans de mouvement aux os individuels que l’évaluation palpatoire de l’ostéopathe doit prendre en compte [2]. Le dysfonctionnement crânien est décrit sur la base de ces axes et plans et doit finalement faire l’objet d’un traitement clinique ostéopathique, soit entre les relations articulaires entre deux os, soit dans le contexte général de l’ensemble du crâne [2]. Nous savons que les sutures et les os crâniens peuvent être plus nombreux et que l’espace occupé par les sutures à l’intérieur du crâne est différent par rapport à l’espace palpé externe [24]. Les articulations suturales, synarthroses ou synchondroses, dentelées ou squameuses, n’effectuent pas de mouvements de rotation ou de flexion-extension ; si l’on veut que la médecine ostéopathique soit considérée comme égale aux autres disciplines scientifiques, il faudra prendre du recul et reconsidérer le mouvement entre les os du crâne avec de nouvelles perspectives.
Synchondrose sphéno-basilaire
Selon l’OCMM, le point d’appui qui permet aux os de se déplacer avec des motifs et des axes est la SSB [2]. Si la relation articulaire entre la base de l’occiput et le corps du sphénoïde montre un dysfonctionnement, ce dernier sera responsable d’anomalies de position spécifiques des os du crâne, détectables par palpation ostéopathique. En fait, les schémas de mouvement décrits dans les textes médicaux ostéopathiques peuvent être le résultat d’illusions tactiles induites par la même étude, comme l’écrit le Dr Frymann [4]. Cette réflexion ne remet pas en cause le fait que les mains de l’ostéopathe sont entraînées à l’écoute palpatoire, sont capables de percevoir de très petites modifications du crâne [25]. On sait que le SSB commence à subir un processus d’ossification avant la puberté, avec un départ intracrânien, pour se terminer dans le cycle pubertaire [1]. Le crâne adulte a une SSB ossifiée et, d’un point de vue scientifique, il n’est pas possible de penser cette articulation comme le principe du mouvement crânien ou comme la cause des différents dysfonctionnements décrits dans l’OCMM [1-2]. Certaines approches manuelles visant à libérer cette articulation ossifiée doivent être reconsidérées (Figure 2).
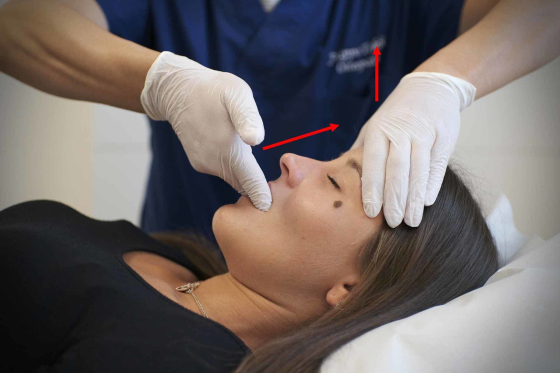
Figure 2 : Décompression manuelle de l’articulation sphéno-basilienne. Cette technique n’a aucune valeur au vu des informations scientifiques actuelles. Les doigts intrabuccaux poussent l’arcade dentaire supérieure dans une direction crânienne, tandis que l’autre main essaie de donner une traction des piliers de l’os frontal, vers le plafond.L’image appartient au Prof. Bruno Bordoni, la technique est réalisée par le Dr Filippo Tobbi avec une collègue en décubitus dorsal. La technique peut être trouvée citée dans la réf. [2].
Propriétés mécaniques du cerveau
Pour essayer de comprendre pleinement le comportement du crâne du point de vue de la médecine ostéopathique, nous devons revoir les caractéristiques mécaniques du cerveau. Sutherland lui-même, en citant les points clés de son modèle crânien, a écrit que pour comprendre le mécanisme de respiration des os crâniens, il était nécessaire d’inclure le cerveau [7]. Le cerveau a un comportement hystérétique, c’est-à-dire un comportement élastique qui lui permet de reconfigurer sa morphologie d’origine en présence de déformations internes ou externes [26]. Mécaniquement, le cerveau est classé comme un corps viscoélastique-poreux. C’est un tissu plein de fluides (80 % -88 %) et de matière solide non linéaire, constamment traversé par différents rythmes de fluides en mouvement et capable de répartir les tensions des neurofluides de manière à récupérer ou maintenir sa forme [26]. Ils présentent des différences régionales dans la distribution des contraintes mécaniques subies mais ces vecteurs de tension, une fois arrivés au cortex, sont assimilés [2b], la matière blanche a une plus grande rigidité (environ un tiers de plus) que la matière grise ; la matière blanche a une plus grande caractéristique anisotrope et participe plus largement à l’élasticité du cerveau [27]. En vieillissant, le cerveau acquiert plus de rigidité, mais conserve sa capacité à répartir les tensions qui traversent sa structure solide-fluide [ 26]. La partie solide est capable de résister à la force des fluides, augmentant la pression hydrostatique, dans un continuum hydromécanique en mouvement et déformation constants [28]. Les forces de déformation mécanique que le tissu nerveux subit à cause du passage des fluides et des mouvements cranio-caudaux et latéraux-médiaux constants résultant secondairement de l’action du cœur et du diaphragme respiratoire sont amortis, précisément en raison de la caractéristique intrinsèque du cerveau. La transmission des forces mécaniques présentées à l’extérieur se répartira à travers les méninges avec une entité et une vitesse diminuées [29]. On pourrait dire que les neurofluides riches en eau font de l’organe cérébral une sorte de diapason en fonction de toutes les notes du corps (informations solides, fluides, magnétiques, électriques et quantiques) dispersées dans tout le corps et à l’extérieur du corps ; les mains de l’ostéopathe lisent le son, déchiffrent une symphonie ou une cacophonie. Le MRS est basé sur les mouvements de la masse cérébrale induits par le myocarde et le diaphragme, qui, grâce aux propriétés mécaniques du cerveau, des neurofluides, des méninges et du complexe os-suture, détecte la santé cardiovasculaire et respiratoire. De plus, la santé des différentes couches du cerveau est palpée par les doigts de l’ostéopathe. Du point de vue de la physique quantique, le contact entre le patient et l’opérateur crée une rencontre bidirectionnelle d’informations magnétiques et quantiques [30]. Cette rencontre influence finalement les molécules d’eau, dont le cerveau est riche. Pour des raisons qui ne sont pas complètement élucidées, les molécules d’eau peuvent conserver la mémoire des substances avec lesquelles elles entrent en contact comme un type d’empreinte, et influencer l’environnement dans lequel ces molécules d’eau persistent [31-32]. Ce mécanisme est peut-être l’une des graines à partir desquelles mûrit l’auto-guérison.
Le mouvement passif du sacrum entre les os iliaques
Selon le modèle de Sutherland, l’os sacré effectue un mouvement de bascule autour d’un axe transversal (S2 et postérieur au canal sacré), appelé axe respiratoire ; le mouvement se produit en raison de la force de mouvement inhérent du système nerveux central, en raison des fluctuations du LCR et grâce aux méninges crâniennes et spinales [33]. Il y aurait une action sacrée consistant à tirer vers le haut et à relâcher vers le bas, de manière rythmique et passive ; le rythme par minute correspondrait au rythme crânien retrouvé par palpation de l’ostéopathe [33]. Selon l’OCMM, lors de la flexion du crâne par le SBS, la base sacrée est tirée cranialement / postérieurement (contre-nutation) alors que l’apex sacré subit un mouvement antérieur vers le pubis. Lors de l’extension du crâne, la base sacrée est libérée en nutation (inférieure / caudale), avec son apex décalé vers l’arrière [33]. Il n’existe pas d’études concrètes prouvant cette théorie. L’articulation sacro-iliaque (ASI) est définie comme une amphiarthrose-diarthrose (os iliaque et aire SI à S3 du sacrum) ; la base du sacrum (SI) et la dernière vertèbre lombaire (L5) créent une symphyse, tandis que les facettes articulaires respectives forment des arthrodies [34]. L’os sacré termine sa maturation à l’âge de 25-30 ans, tandis que la fusion des vertèbres sacrées se termine à l’âge de 20 ans [34]. Dans 6 % de la population d’Amérique du Nord, il y a une sacralisation, c’est-à-dire que le corps de L5 se confond avec la base du sacrum ; il peut y avoir une fusion partielle et une fusion pouvant impliquer les facettes articulaires, avec une grande variabilité morphologique articulaire [34]. Après la quarantaine, il n’est pas rare d’observer des fusions entre l’apex du sacrum et l’os coccygien [34]. La zone articulaire de l’ASI au niveau de S3, devient plus sagittale avec l’âge, comparée aux portions de SI et S2 ; il est également possible de trouver de petites articulations accessoires de l’ASI [34]. L’ASI est innervée par les branches postérieures de L5-S4 ; dans l’articulation, existent également des fibres myélinisées et non myélinisées encapsulées, qui peuvent être classées dans le groupe des fibres de type IV et III [34]. En position debout et assise, l’angle entre L5 et SI devient plus aigu, avec nutation du sacrum, le complexe ligamentaire postérieur est mis en tension et les os iliaques ont tendance à se translater dorsalement [34]. Malgré la musculature impliquée, le mouvement de l’os sacré est passif (Figure 5) [35].
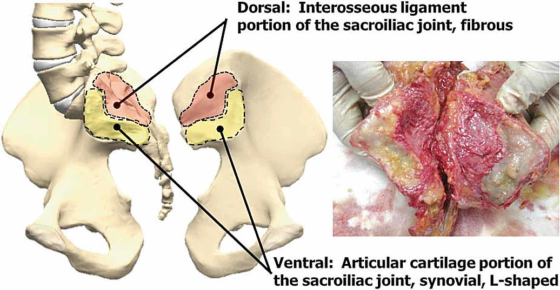
Figure 3 : La figure illustre la complexité de l’ASI et des différentes surfaces articulairesASI, articulation sacro-iliaque.Remerciements au Dr Kiapour A, Centre d’ingénierie pour l’excellence en recherche orthopédique (E-CORE), Départements de bio-ingénierie et d’orthopédie, Université de Toledo, Toledo, Ohio, États-Unis.
La palpation sacrée de l’anatomie pertinente par l’ostéopathe est quelque peu remise en question par la science actuelle. L’os sacré peut bouger dans toutes les directions entre les os iliaques, bien que l’ampleur du mouvement puisse rarement dépasser 2 mm, avec une moyenne de 1,6 mm et un maximum de 2 degrés [34-35]. Chaque mouvement est la somme de plusieurs mouvements ; par exemple, nutation et contre-nutation sont la somme d’une rotation et d’une translation [34]. Pendant le cycle de marche, dans les phases d’oscillation où une jambe porte le poids du corps, l’ASI est tirée vers le bas depuis le côté de la jambe libre et subit une contre-nutation, par rapport à l’iliaque ; L’iliaque est abaissé du côté de la jambe oscillante [36]. En phase d’appui, l’iliaque du côté du pied de contact est relevé par rapport au sacrum, tandis que ce dernier, effectue passivement une nutation [36]. Dans les phases d’oscillation, l’ASI se déplace d’environ 0,3 mm et d’environ 0,6 mm dans les phases d’appui [36]. Une étude révèle que lors de l’étape, il doit y avoir un mouvement d’anticipation de l’os sacré pour améliorer la répartition des charges corporelles [37]. Lorsque le patient est en décubitus dorsal, la contre-nutation de la base sacrée est la position prédominante [34]. Selon d’éminents auteurs, il n’y a pas de test manuel valide pour identifier adéquatement le mouvement du sacrum par rapport aux os iliaques, et aucune manœuvre manuelle ne peut modifier la position de l’os sacré [34]. Avec des approches manuelles de l’ASI, la position de ce dernier ne change pas, mais les réponses neuronales sont activées [diminution de l’activité du motoneurone spinal et diminution du réflexe de Hoffman (H)] [38-39]. Quelle est la nature des rythmes palpés par l’ostéopathe au niveau du sacrum, par rapport au rythme identique enregistré manuellement par le crâne ? On sait que le sacrum est influencé non seulement par les mouvements des jambes, mais aussi par les mouvements des vertèbres lombaires et en partie par la respiration qui, en activant la musculature du plancher pelvien, influence légèrement le mouvement sacré entre les os iliaques [34-35]. Pour comprendre la nature du rythme cranio-sacré, nous devons probablement repenser l’anatomie et les caractéristiques fonctionnelles des méninges et des neurofluides spinaux. La dure-mère vertébrale au niveau lombaire et sacré a une épaisseur réduite (103,74 ± 21,54 pm), comparée aux régions cervicale et thoracique ; la couche interne comporte un plus grand nombre de fibres de collagène que la couche externe, avec une grande capacité à résister aux charges axiales [40]. Le sac dural se termine au niveau de Sl-S2, la zone où est identifié l’axe transversal des mouvements sacrés [34, 41]. Le sac dural est maintenu en place par les ligaments méningovertébraux, qui sont reliés aux lames et au ligament jaune [42]. Dans les méninges spinales sacrées, on retrouve la couche arachnoïdienne et l’espace sous-arachnoïdien avec les mêmes caractéristiques cérébrales fonctionnelles (ainsi que l’anisotropie durale) [40]. La pie-mère, qui recouvre la moelle épinière, se confond au niveau du filum terminal, passant au-delà du cône médullaire ; il est constitué de collagène et de fibres réticulaires [43]. Le filum terminal est ancré au coccyx par la pie-mère, et les caractéristiques fonctionnelles de la pie-mère à ce niveau permettent de maintenir un état de tension et d’élasticité adéquat ; la pie-mère est recouverte au niveau du filum terminal par l’espace sous-arachnoïdien [43]. Pour un meilleur ancrage, la couche piale possède des ligaments denticulés, qui créent une relation plus stable entre la moelle et la couche durale [43]. Les méninges rachidiennes lombaires et sacrées ont les mêmes fonctions mécaniques que les méninges du crâne. Sur un modèle animal, le LCR au niveau sacré a une vitesse plus élevée que dans les autres zones vertébrales ; il a tendance à s’accumuler au niveau sacré, pour être ensuite absorbé à travers l’espace sous-dural par les vaisseaux lymphatiques [44]. Dans la zone sacrée, on trouve un plus grand nombre de vaisseaux lymphatiques que dans les autres zones spinales ; le LCR restant traverse l’espace épidural (espace entre la dure-mère et le ligament jaune), où il n’y a pas de barrière arachnoïdienne avec les sorties nerveuses [43-44]. Au niveau de L5-S2, la moelle épinière s’élargit chez l’homme et cela pourrait coïncider avec l’étude sur un modèle animal, où il y a une plus grande collection de LCR et une plus grande présence de vaisseaux lymphatiques [45]. La moelle épinière et la queue de cheval, en plus de se déplacer cranio-caudalement pour la stimulation cardiaque et respiratoire, subissent des oscillations de moins de 1 mm, probablement dues au mouvement oscillatoire du LCR [46]. Ces oscillations et mouvements du muscle diaphragme et du rythme cardiaque ne coïncident pas avec le rythme cranio-sacré. On peut supposer qu’au niveau sacré (y compris les os) existent les mêmes conditions viscoélastiques et mécaniques qui permettent d’amortir et de ralentir ces rythmes vitaux (rythme cardiaque et respiratoire), au fur et à mesure que ces variations de tension atteignent la surface (peau). Il faut également souligner le fait que l’ASI elle-même a une grande capacité à amortir de fortes charges mécaniques, et cette congruence articulaire est une autre pièce possible pour comprendre la dichotomie entre les rythmes palpés et les rythmes vitaux [36]. Les fluides corporels et les neurofluides donnent la forme et la fonction des tissus solides, et permettent à ces derniers de conserver un statut salutogène [47]. On peut émettre l’hypothèse que lorsque l’ostéopathe palpe le crâne et l’os sacré, en plus de percevoir la santé cardio-respiratoire (et autres zones du corps), le clinicien est capable de palper le MRS grâce aux neurofluides. Sans le déplacement constant des neurofluides, il n’y aurait pas de rythme perceptible. L’ostéopathe ne fait pas un remodelage osseux : les os ne changent ni de position ni de forme sous l’effet de stimuli manuels, tout comme les sutures crâniennes ne se séparent pas. Les stimuli manuels que l’ostéopathe peut donner avec la palpation du crâne et du sacrum partent mécaniquement de l’épiderme. Un toucher doux est capable d’activer les afférents des mécanorécepteurs myélinisés et non myélinisés (A (3, A5) ; cette activation stimule la libération de substances opioïdes de la moelle épinière, ce qui va inhiber les voies nociceptives grâce à l’intervention du système parasympathique, l’intervention du réflexe somato-cardiaque et respiratoire, avec abaissement des rythmes vitaux [48-49]. Ce mécanisme est bidirectionnel (patient-opérateur) [49]. En agissant sur l’abaissement du système sympathique par approche manuelle ostéopathique, il est possible de supposer que les mains de l’ostéopathe affecteront les rythmes des neurofluides et la santé (Figure 4) [50].
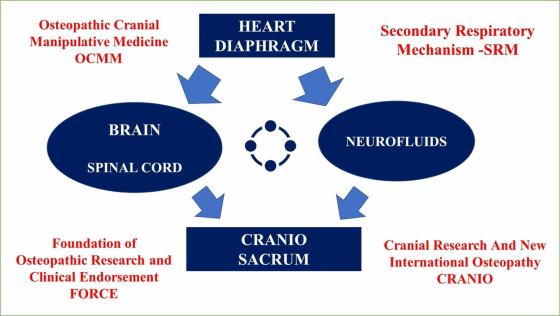
Figure 4 : Le schéma résume le concept de MRS.MRS, mécanisme respiratoire secondaire
Conclusions
La deuxième partie de l’article traitait des composants restants de l’OCMM, à savoir la mobilité articulaire des os du crâne, la SSB, les caractéristiques mécaniques du cerveau et le mouvement du sacrum entre les os iliaques. La nécessité de trouver un autre modèle de médecine ostéopathique crânienne capable de refléter plus fidèlement les notions scientifiques mises à jour a été soulignée. Nous avons proposé une nouvelle manière de décrire les mécanismes sous-jacents à l’OCMM ; non plus MRP mais MRS. Pour conclure, nous avons souligné l’importance des neurofluides et la fonction stratégique qu’ils jouent dans le rôle d’un stimulus salutogène.
Bordoni B, Walkowski S, Ducoux B, et al.
distributed under the terms of the Creative Commons Attribution License CC-BY 4.0
10.7759/cureus.10435
Traduction par Pierre Tricot
Information additionnelle
Divulgations
Conflits d’intérêts : Conformément au formulaire de divulgation uniforme de l’ICMJE, tous les auteurs déclarent ce qui suit : Informations sur le paiement / les services : Tous les auteurs ont déclaré qu’aucune organisation n’avait reçu de soutien financier pour le travail soumis. Relations financières : tous les auteurs ont déclaré n’avoir aucune relation financière à l’heure actuelle ou au cours des trois années précédentes avec des organisations qui pourraient avoir un intérêt dans le travail soumis. Autres relations : tous les auteurs ont déclaré qu’il n’y avait aucune autre relation ou activité qui pourrait sembler avoir influencé le travail soumis.