Présentation
Titre original : Somatic dysfunction : An osteopathic conundrum
Traduction : Pierre Tricot DO, février 2018.

Résumé
Le dysfonctionnement somatique est considéré comme un concept central pour la théorie et la pratique de l’ostéopathie, mais sa pertinence pour la profession moderne est discutable en raison de sa physiopathologie peu claire et de sa mauvaise fiabilité de détection. Cet article explorera les facteurs susceptibles de produire des signes cliniques attribués à un dysfonctionnement somatique et discutera de la plausibilité du concept. Un modèle conceptuel est présenté pour les indices diagnostiques cliniques attribués au dysfonctionnement somatique intervertébral, où les signes de dysfonctionnement proviennent de facteurs tissulaires et neurologiques liés à un cycle de lésion tissulaire et à des changements fonctionnels nociceptifs. Enfin, la pertinence du concept de dysfonctionnement somatique à la profession ostéopathique moderne est discutée et des recommandations pour la profession ostéopathique sont faites.
Mots-clés : médecine ostéopathique ; Diagnostic ; Palpation ; Dysfonctionnement somatique
Sommaire
I. Introduction
II. Facteurs tissulaires contribuant aux signes cliniques d’un dysfonctionnement somatique
A. Blessure à l’articulation zygapophysaire
B. Piégeage ou extrapolation de plis synoviaux
C.Les changements du tissu conjonctif articulaire
D. Dégénérescence discale intervertébrale
III. Modifications fonctionnelles nociceptives contribuant aux signes cliniques d’une dysfonction somatique
IV. Causes plausibles des signes cliniques d’un dysfonctionnement somatique
A. Fiabilité et validité du diagnostic
B. Confondeurs pour le diagnostic palpatoire
C. Le langage du dysfonctionnement
VII. Conclusion
Remerciements
Références
I - Introduction
Bien avant l’apparition de l’ostéopathie, les praticiens de la thérapie manuelle ont essayé de comprendre et d’expliquer les causes et la pertinence des résultats cliniques palpatoires qui semblent être associés aux plaintes des patients et à la résolution des manipulations manuelles. Au fil des années, de nombreuses théories, simples et complexes, ont été postulées pour expliquer les résultats palpatoires et justifier le traitement manuel.
Le dysfonctionnement somatique, et son terme prédécesseur de « lésion ostéopathique », a été considéré comme un concept central de la théorie et de la pratique de l’ostéopathie pendant plus d’un siècle (1,2). Pour de nombreux praticiens, le terme représente une seule entité clinique diagnostiquée exclusivement par des ostéopathes en utilisant la palpation, qui influe sur la douleur, la fonction et la santé en général, et est traitée de façon appropriée en utilisant la manipulation. Pour d’autres, la dysfonction somatique représente un concept anachronique et obsolète du début du XXe siècle qui renforce la croyance en une cause structurelle ésotérique de la douleur. Cet article explorera les facteurs qui peuvent produire des signes cliniques attribués à un dysfonctionnement somatique et discutera de la plausibilité et de la pertinence du concept de dysfonctionnement somatique dans la profession moderne. L’auteur soutient qu’un large modèle conceptuel pour ces signaux palpatoires peut aider le raisonnement clinique pendant l’examen physique, mais que le terme « dysfonctionnement somatique » n’a plus d’utilité clinique pour formuler un diagnostic ou décrire les résultats cliniques à d’autres praticiens.
Le dysfonctionnement somatique a été défini comme un affaiblissement (?) ou une altération de la fonction des composantes connexes du système somatique (structure corporelle) : structures squelettiques, arthrodiales et myofasciales, et éléments vasculaires, lymphatiques et neuraux connexes (3). Il est proposé d’être réversible perturbation fonctionnelle qui prédispose le corps à la maladie (4), où la manipulation est le traitement spécifique et efficace (5). Le terme peut être utilisé pour désigner un dysfonctionnement d’un groupe de tissus ou d’une région, ou utilisé plus spécifiquement pour le dysfonctionnement d’une seule articulation. La dysfonction somatique n’est pas synonyme de douleur rachidienne et des signes de dysfonction palpable peuvent être détectés chez des individus symptomatiques et asymptomatiques (6). Il a été proposé que la présence de dysfonctionnement somatique chez des individus asymptomatiques crée des conséquences biomécaniques et neurologiques prédisposant l’individu à la douleur et autres complaintes de santé. Cet article se concentrera sur le concept de dysfonctionnement somatique des articulations du segment rachidien, alternativement appelé dysfonctionnement somatique intervertébral, dysfonctionnement intervertébral, lésion intervertébrale ou dysfonction segmentaire (8,9,10).
L’auteur a déjà exploré le concept de dysfonctionnement somatique par rapport à l’évidence moderne et suggéré un modèle pour expliquer les sources probables des signes palpables de dysfonctionnement (8,9,11). Dans un article de 1999 (8), l’auteur soutenait que le concept de dysfonctionnement somatique reposait en grande partie sur des recherches dépassées et les progrès dans les domaines du contrôle moteur et de la science de la douleur ont nécessité des changements au concept. En 2003, l’auteur a suggéré un modèle qui incluait des facteurs patho-anatomiques associés à la déformation et à la dégénérescence et aux conséquences fonctionnelles nociceptives (9). Ce modèle n’était pas destiné à décrire la dysfonction somatique en soi mais à offrir une variété de causes plausibles. attribué à un dysfonctionnement somatique. En raison des progrès dans les preuves pertinentes, ce sujet nécessite maintenant un examen plus approfondi et une discussion.
La dysfonction somatique serait détectée par palpation à l’aide de quatre signes cliniques cardinaux : tendresse (souplesse des tissus ?), asymétrie, anomalie de l’amplitude des mouvements et modifications de la texture des tissus (1,5,12,13). Le symbole TART ou ARTT est couramment utilisé comme aide-mémoire pour les signes cliniques. Certains auteurs n’incluent pas la sensibilité en tant que signe clinique1 ou la « sensibilité » de substitution à la tendresse (5). Au moins deux de ces signes doivent être présents pour un diagnostic de dysfonctionnement somatique (13). La plupart des auteurs considèrent la restriction du mouvement comme une caractéristique importante de la dysfonction somatique (5,13, 14), bien que certains auteurs décrivent une anomalie du mouvement comme étant réduite ou augmentée (1,12). La fiabilité de la détection de ces signes cliniques sera discutée plus loin dans cet article.
Le dysfonctionnement somatique est souvent décrit comme une perturbation fonctionnelle réversible (4) et n’est toujours pas considéré comme un dysfonctionnement somatique en présence d’une pathologie (15). Pour examiner toutes les causes probables des troubles diagnostiques du dysfonctionnement somatique, l’auteur propose une modification tissulaire et dégénérative comme celle affectant les articulations zygapophysaires ou les disques intervertébraux, doit être prise en compte en plus des changements purement fonctionnels. Bien que les pathologies déformatives et dégénératives puissent être considérées comme des comorbidités aux perturbations fonctionnelles (11), l’incapacité de différencier les causes des signaux palpatoires par la seule palpation est une raison d’inclure à la fois des aspects pathologiques et fonctionnels dans n’importe quel modèle.
Le dysfonctionnement somatique est souvent décrit comme une perturbation fonctionnelle réversible (4) et n’est toujours pas considéré comme un dysfonctionnement somatique en présence d’une pathologie (15). Pour examiner toutes les causes probables des troubles diagnostiques du dysfonctionnement somatique, l’auteur propose une modification tissulaire et dégénérative comme celle affectant les articulations zygapophysaires ou les disques intervertébraux, doit être prise en compte en plus des changements purement fonctionnels. Bien que les pathologies déformatives et dégénératives puissent être considérées comme des comorbidités aux perturbations fonctionnelles (11), l’incapacité de différencier les causes des signaux palpatoires par la seule palpation est une raison d’inclure à la fois des aspects pathologiques et fonctionnels dans tout modèle des signaux palpatoires de dysfonctionnement. D’autres pathologies, telles que les arthrites inflammatoires, peuvent également potentiellement produire un changement palpable, mais ces pathologies peuvent être différenciées des causes fonctionnelles et dégénératives à travers l’histoire clinique et d’autres tests cliniques.
Les causes proposées de signes cliniques attribués à un dysfonctionnement somatique sont en grande partie spéculatives et manquent de preuves de grande qualité à l’appui, mais l’auteur soutient qu’il est possible de présenter des causes plausibles pour les signes cliniques fréquemment cités.
II - Facteurs tissulaires...
II - Facteurs tissulaires contribuant aux signes cliniques d’un dysfonctionnement somatique
De nombreux facteurs tissulaires, liés par des antécédents naturels de lésions et de changements dégénératifs, sont susceptibles de contribuer aux signaux palpables d’un dysfonctionnement somatique. Les facteurs tissulaires qui peuvent contribuer à ces indices palpables comprennent la lésion et l’inflammation de l’articulation zygapophysaire ; piégeage ou extrapolation de plis synoviaux dans l’articulation zygapophysaire ; remodelage du tissu conjonctif à l’intérieur et autour de l’articulation zygapophysaire ; Les autres pathologies non abordées dans cet article peuvent également créer des signes palpables, mais l’histoire du patient fournira des informations sur la probabilité d’une pathologie locale et systémique, comme les arthrites inflammatoires, qui peuvent être confirmées par d’autres pathologies. tests médicaux.
A - Blessure à l’articulation zygapophysaire
Une entorse de l’articulation zygapophysaire a été postulée comme cause de douleur rachidienne et de dysfonctionnement intervertébral (9,16). Des études utilisant des blocs anesthésiques diagnostiques ont confirmé que l’articulation zygapophysaire est une source commune de douleur rachidienne et peut produire à la fois des douleurs locales et dirigées (16). Bien que la cause de la douleur reste difficile à cerner, les lésions de la capsule articulaire zygapophysaire et les fractures par avulsion ont été identifiées à la suite d’une blessure (16).
Un traumatisme peut donc entraîner une entorse de la capsule articulaire zygapophysaire, une inflammation et un épanchement articulaire, ainsi que des lésions d’autres tissus autour du segment intervertébral. Par conséquent, il est plausible qu’une entorse et un épanchement puissent causer ou contribuer à tous les signes diagnostiques d’un dysfonctionnement somatique segmentaire : douleur et sensibilité paraspidienne profonde causée par l’inflammation des ligaments et des capsules, mouvement articulaire restreint avec altération des articulations et épanchement articulaire. la congestion des tissus et les modifications de la texture des tissus telles que la dureté ou le « bogginess » de l’inflammation et de la congestion des muscles périarticulaires et des tissus.
Bien que les entorses articulaires zygapophysaires semblent être une cause plausible de douleur rachidienne aiguë, il y a un manque de preuves cliniques à l’appui. Nazarian et ses collaborateurs (18) ont étudié l’inflammation articulaire zygapophysaire cervicale et lombaire chez des patients symptomatiques qui utilisaient des ultrasons diagnostiques, mais ils étaient incapables de démontrer une échogénicité anormale dans ou à proximité des articulations. Fryer et Adams (19) ont examiné cinq volontaires présentant une douleur unilatérale aiguë « crick in the neck » dans les 24 heures suivant l’apparition de la douleur ; les auteurs ont postulé que cette population serait susceptible d’avoir des signes inflammatoires. Les volontaires ont été examinés pour déterminer le côté et le niveau de la douleur au cou, et l’examen a été suivi par l’imagerie par résonance magnétique du cou. Aucun signe d’inflammation des articulations cervicales ou d’épanchement articulaire n’a été détecté, mais l’étude n’a pas écarté la possibilité d’une inflammation occulte et des méthodes d’imagerie plus sensibles ont été nécessaires pour la détection (19) Par conséquent, si une inflammation survient dans les articulations zygapophysaires. douleur bénigne du cou suite à un traumatisme trivial, il doit être subtile.
B - Piégeage ou extrapolation de plis synoviaux
Le piégeage ou l’extrapolation des plis synoviaux a été proposé comme mécanisme de la douleur articulaire aiguë avec blocage (5,16,20) Les plis synoviaux ressemblant à des méniscoïdes se produisent dans les articulations zygapophysaires du rachis lombaire et cervical et agissent comme des « remplisseuses spatiales passives » qui remplissent les parties périphériques non congruentes de l’articulation dans sa position neutre mais se déplacent lorsque l’articulation se déplace (16, 20).
Certains auteurs ont spéculé que ces plis synoviaux sont piégés (enflés et enflammés par un traumatisme mineur qui empêche le glissement des surfaces articulaires opposées) ou extrapolés (attachés et retenus sur la marge articulaire pendant la flexion complète qui empêche la surface supérieure de glisser vers le bas et vers l’arrière) (5,16,20). La signification clinique de ces plis synoviaux est largement inconnue, mais ils sont probablement blessés et deviennent une source de douleur dans des conditions traumatiques du cou telles que le coup de fouet cervical (20). Les hypothèses de piégeage et d’extrapolation semblent plausibles pour un dysfonctionnement somatique. l’articulation de la colonne vertébrale est extrêmement douloureuse et « bloquée » en flexion, mais ces explications sont spéculatives en raison de l’absence de preuves directes (16,20).
C - Les changements du tissu conjonctif articulaire
Les adhérences intra-articulaires, la fibrose articulaire et la laxité ligamentaire ont toutes été suggérées comme des conséquences de blessures et des causes de mobilité articulaire perturbée (8,9,21,22,23). Des adhérences dans l’articulation zygapophysaire ont été suggérées comme cause de mobilité segmentaire restreinte (21,22). Bien que des adhérences aient été observées chez des rats après l’immobilisation de l’articulation zygapophysaire par une fixation chirurgicale (22), il n’y a pas d’évidence chez les humains. Les adhérences intra-articulaires ne tiennent pas compte de l’hypomobilité aiguë ou transitoire en raison du temps requis pour la formation d’adhérences, mais les adhérences doivent être une considération théorique lorsque l’hypomobilité segmentaire chronique suit une période d’immobilisation.
En variante, une déformation et une lésion continues de la capsule zygapophysaire et des ligaments capsulaires peuvent produire un remodelage et un allongement de ces tissus conjonctifs. Une déformation continue peut entraîner un fluage viscoélastique, des lésions et un remodelage des ligaments articulaires, entraînant une laxité ligamentaire à long terme et une hypermobilité articulaire (23,24). Les ligaments lésés cicatrisent avec le tissu cicatriciel, ce qui affaiblit les propriétés biomécaniques du tissu et ne guérit pas complètement au cours du temps (25,26). Bien que l’on suggère généralement que le dysfonctionnement somatique implique une hypomobilité segmentaire (5,14,27) certains auteurs affirment que le signe clinique du mouvement « altéré » dans le dysfonctionnement somatique inclut également l’hypermobilité (1,12). Où l’hypermobilité segmentaire s’est développée le segment peut devenir plus susceptible de subir d’autres blessures et d’entorse, ce qui renforcerait d’autres signes cliniques de dysfonctionnement, tels que la sensibilité et le changement de la texture des tissus.
Dans les deux cas, le remodelage du tissu conjonctif de la capsule et des ligaments peut être responsable de changements de mobilité à long terme. Il y a plus de signes de laxité ligamentaire et d’hypermobilité que d’hypomobilité associée à la douleur rachidienne, en particulier suite à un traumatisme comme le coup de fouet cervical (23) et, compte tenu du manque de preuves directes d’adhérences intra-articulaires et de changements fibrotiques sont plus spéculatifs. Cependant, les adhérences intra-articulaires peuvent être des causes plus plausibles d’hypomobilité articulaire lorsque la blessure est suivie d’une période prolongée d’immobilisation (22).
D - Dégénérescence discale intervertébrale
Les disques intervertébraux sont une source de douleurs lombaires chroniques mais ne peuvent généralement pas être diagnostiqués à partir de l’anamnèse ou de l’examen physique (16,28). Certains auteurs ont attribué des signes de dysfonctionnement somatique segmentaire, comme la douleur due à la pression manuelle et au mouvement de fin de Bien (?) que la dégénérescence discale puisse être sans rapport avec la douleur ou les symptômes de la colonne vertébrale, la dégénérescence (31,32) réduit le mouvement du segment dans toutes les directions, ce qui peut être détecté par la palpation du mouvement et les accessoires. Les lésions du disque peuvent produire une contraction réflexe du multifidus (35) et produire potentiellement un changement palpable du tissu paraspinal, mais les preuves d’une activité électromyographique anormale associée à des résultats palpatoires font défaut (36,37,38). Par conséquent, les lésions discales intervertébrales, les perturbations et dégénérescence ont le potentiel de produire de nombreux signes cardinaux de dysfonction somatique, en particulier un mouvement segmentaire réduit. D’autres arthrites inflammatoires spécifiques et des pathologies rachidiennes peuvent également causer de la douleur et des signaux palpables, mais ils ne sont pas considérés ici car ils sont généralement identifiés par les antécédents cliniques et l’imagerie diagnostique et ne sont généralement pas le résultat d’une lésion légère ou dégénérative.
III - Modifications...
III - Modifications fonctionnelles nociceptives contribuant aux signes cliniques d’une dysfonction somatique
Les modèles neurologiques pour le dysfonctionnement somatique ont gagné le plus d’acceptation et de longévité dans la profession ostéopathique. Korr a développé le modèle du « segment facilité » (39,40) basé sur une recherche pionnière menée dans les années 1940 et 1950. Ses recherches suggèrent que des blessures (lésions) myofasciales pourraient produire des réactions motrices et sympathiques segmentaires exagérées (41,42,43). Cependant, cette recherche présentait des lacunes majeures et ne validait pas le concept de dysfonction somatique (44,45). Dans le modèle de Korr, entrée afférente aberrante dans la moelle épinière, un mouvement ou un traumatisme mal exécuté a été proposé pour « faciliter » et abaisser le seuil des interneurones spinaux, produisant un écoulement sensoriel, moteur et sympathique exagéré à partir du segment impliqué. En 1990, Van Buskirk propose une modification du modèle Korr qui souligne l’importance du nocicepteur dans la production de réponses motrices et sensorielles46. Van Buskirk souligne également le rôle possible du réflexe axonal nocicepteur dans la production de modifications tissulaires (46). Dans les deux modèles, segmentaire les troubles du mouvement étaient attribués à la contraction ou à la contraction musculaire, et les changements tissulaires étaient largement attribués à la contraction musculaire. Cependant, il existe peu de preuves qu’une contraction musculaire anormale est associée à un dysfonctionnement somatique36, 37 et une activité électromyographique anormale n’a pas été retrouvée dans les muscles spinaux profonds paravertébraux qui semblent anormaux à la palpation au repos dans des études récentes (38,47).
Au fur et à mesure que notre compréhension de la science de la douleur s’est élargie au cours des dernières décennies, le concept de segmentation facilitée de Korr a été largement dépassé par le concept moderne de sensibilisation centrale. Les deux concepts partagent plusieurs caractéristiques similaires, y compris l’initiation par un bombardement de l’activité afférente, la sensibilisation des neurones de la corne dorsale, et la facilitation des voies nociceptives. Cependant, le modèle du segment facilité a mis l’accent sur les effets moteurs sympathiques et les changements segmentaires et a justifié le traitement manipulatoire pour influencer les troubles musculo-squelettiques et viscéraux (7), alors qu’une sensibilisation centrale a été développée pour expliquer l’expérience douloureuse. Le système nerveux central (SNC), y compris les centres supérieurs (48). La sensibilisation centrale se produit lorsque les intrants nocicepteurs déclenchent une augmentation prolongée de l’excitabilité et de l’efficacité synaptique des neurones dans les voies nociceptives centrales (49). La réorganisation fonctionnelle et anatomique de la corne dorsale et des centres supérieurs du SNC produit une activation de la voie nociceptive prolongée. Les processus neuroplastiques sous-jacents ont été bien décrits ailleurs (49,50). L’hyperexcitabilité neuronale de la corne dorsale a été démontrée après une lésion articulaire facettaire douloureuse (51), bien que l’entrée nociceptive et la sensibilisation subséquente puissent provenir de n’importe quel tissu innervé.
Les caractéristiques cliniques de la sensibilisation centrale sont l’hyperalgésie, où normalement les stimuli douloureux produisent une douleur exagérée ; l’allodynie, où des stimuli normalement non douloureux tels que le toucher léger ou le mouvement produisent de la douleur ; et une augmentation générale de la réponse à une variété d’autres stimuli (52). La réponse exagérée de la douleur aux stimuli peut durer plus longtemps que la lésion tissulaire périphérique initiale, ce qui entraîne une transition de la douleur vers l’origine du SNC. Par conséquent, la sensibilisation centrale, avec ses aspects d’hyperalgésie et d’allodynie, explique la constatation clinique de la sensibilité lors de l’évaluation d’un dysfonctionnement somatique, même si une lésion tissulaire n’est plus présente, bien que la sensibilité puisse être généralisée si la sensibilisation est un processus clé. Les implications cliniques de la douleur généralisée aux ostéopathes sont profondes et seront discutées plus tard.
Les nocicepteurs activés peuvent également contribuer aux changements de texture des tissus attribués à un dysfonctionnement somatique. L’inflammation neurogène accompagne régulièrement l’excitation des nocicepteurs afférents primaires. Les nocicepteurs activés peuvent agir de façon motrice lorsque les potentiels d’action antidromique de la moelle épinière vers la périphérie provoquent la sécrétion de neuropeptides pro-inflammatoires puissants à partir de ces fibres sensorielles pour favoriser l’inflammation tissulaire (53,54) Ces « réflexes radiculaires dorsaux » Les inflammations neurogéniques ont également été suggérées comme un mécanisme possible de l’inflammation et des signes associés à un dysfonctionnement somatique (9,57) Bien que les réflexes radiculaires dorsaux l’inflammation neurogène est déclenchée par des facteurs locaux dans les tissus périphériques, l’inflammation neurogène peut également être générée à partir des voies centrales descendantes. Il a été démontré que la stimulation de la substance grise périaqueducale dans le mésencéphale produit des réflexes radiculaires dorsaux d’une manière dépendante de la fréquence.58 Par conséquent, l’inflammation neurogène peut être responsable des changements de texture des tissus ou contribuer à leur inflammation. à une lésion tissulaire périphérique existante.
D’un point de vue clinique, la douleur affecte le contrôle moteur, l’activation et la taille des muscles, l’intégration sensorimotrice et la proprioception. Une atrophie des muscles profonds parasinaux au niveau du segment douloureux a été rapportée dans la lombalgie et peut survenir rapidement (59,60,61,62). L’atrophie des muscles profonds peut potentiellement être une autre source de résultats palpatoires anormaux, bien qu’une atrophie n’ait pas été (observée), démontré chez des participants sains avec des signaux palpables (63).
Ces changements fonctionnels nociceptifs peuvent expliquer certains des résultats palpables attribués à la dysfonction somatique, en particulier, la neuroplasticité centrale et la sensibilisation contribuant à la douleur et la tendresse et l’inflammation neurogène contribuant aux changements de texture des tissus. Bien que certains auteurs (4,46) aient spéculé que de tels changements puissent aussi être initiés par un apport nocif des viscères, les effets seraient probablement diffus sur plusieurs segments plutôt que localisés à un seul « dysfonctionnement segmentaire » en raison de la convergence des afférences viscérales dans la corne dorsale (57).
IV - Causes plausibles ...
IV - Causes plausibles des signes cliniques d’un dysfonctionnement somatique
Une multitude de facteurs neurologiques et tissulaires peuvent causer ou contribuer aux signaux palpables attribués à un dysfonctionnement somatique. Les changements fonctionnels dirigés par le nociceptif peuvent produire des altérations de la texture des tissus et de la sensibilité à la douleur, deux des caractéristiques cardinales attribuées au dysfonctionnement somatique par les ostéopathes. De plus, il semble probable qu’un certain nombre de processus comorbides impliquant une lésion et une dégénérescence tissulaires contribuent également à la texture des tissus et à l’amplitude des mouvements et à l’activation des voies nociceptives.
La dysfonction somatique est communément décrite comme étant aiguë ou chronique (5,13), et ces stades sont probablement liés à une inflammation tissulaire aiguë ou à un changement dégénératif à long terme, les deux pouvant être accompagnés de changements neurologiques et fonctionnels. Au stade aigu du dysfonctionnement, la sensibilité est le plus facilement expliquée par l’activation du nocicepteur et la sensibilisation périphérique suite à une lésion tissulaire. À plus long terme, les modifications neuroplastiques nociceptives de la corne dorsale et du système nerveux central supérieur potentialisent la douleur et la sensibilité.
Les signes cliniques d’asymétrie, tels que l’asymétrie apparente de la plénitude paraspinale, peuvent être causés par des modifications tissulaires ou motrices affectant un côté de la colonne vertébrale plus que l’autre. Les textes ostéopathiques et les modèles biomécaniques associés ont postulé que l’asymétrie des repères osseux, tels que les processus transverses ou épineux de la vertèbre, sont des signes cliniques de dysfonctionnement (1,5,13). Il a été proposé qu’un segment rachidien puisse adopter un repos neutre « pathologique » en cas de perte de mouvement importante dans une direction1 ou de glissement de facette restreinte en flexion ou en extension, positionner l’articulation dans une position pivotée ou fléchie latéralement (64). Cependant, ces asymétries et leurs causes proposées sont entièrement spéculatives, et l’asymétrie naturelle des repères osseux est susceptible d’être commun et un facteur de confusion pour ce signe de diagnostic.
Les changements de mouvement dans le stade aigu du dysfonctionnement peuvent être provoqués par des changements inflammatoires et la congestion du liquide tissulaire après une lésion des tissus mous segmentaires, tels que les muscles, les ligaments et la capsule articulaire, et peuvent être favorisés par une inflammation neurogène. Malgré l’absence de signes d’inflammation profonde dans les douleurs rachidiennes aiguës bénignes, une congestion tissulaire périarticulaire et un épanchement synovial pourraient potentiellement se produire et produire une résistance tissulaire à un mouvement complet. L’extrapolation du pli synovial peut être responsable dans des cas plus rares de bas du dos en flexion, mais ce mécanisme est plus spéculatif. Les changements dégénératifs du disque et de l’articulation zygapophysaire, le remodelage et la fibrose de la capsule articulaire et des tissus conjonctifs environnants ont le potentiel de provoquer des changements à long terme dans le mouvement du segment, soit une diminution ou une mobilité accrue. De plus, l’activité musculaire peut contribuer aux changements de mouvement. La protection musculaire réflexe semble improbable à moins d’une lésion importante des structures profondes de la colonne vertébrale, mais un comportement de protection volontaire et non volontaire dû à l’hypervigilance et à la peur de la douleur peut potentiellement entraîner une restriction du mouvement, bien que ces changements soient probablement régionaux.
Les anomalies de la texture des tissus sont probablement causées par une inflammation associée à une lésion aiguë de la colonne vertébrale et des tissus environnants, une inflammation neurogène associée à des nocicepteurs activés et à des voies nociceptives, et un comportement protecteur des muscles incapables de se relaxer complètement. De plus, l’atrophie musculaire profonde associée à la douleur rachidienne peut être une source de changement de texture.
V - Un modèle...
V - Un modèle pour les signes cliniques de dysfonctionnement somatique
Dans la Fig.1, un modèle est présenté pour les signes cliniques attribués à un dysfonctionnement somatique basé sur les modèles précédents de l’auteur (8,9). Ce modèle ne présente pas la dysfonction somatique comme une entité clinique unique mais comme la production de signes cliniques nociceptifs. les changements fonctionnels entraînés et les facteurs de tissu patho-anatomiques comorbides associés à la déformation et à la dégénérescence. Différents facteurs peuvent prédominer chez différents individus. C’est un modèle pour les signes cliniques palpatoires attribués au dysfonctionnement somatique et non pour la douleur rachidienne, et ces signes palpables peuvent exister avec ou sans présence de symptômes.
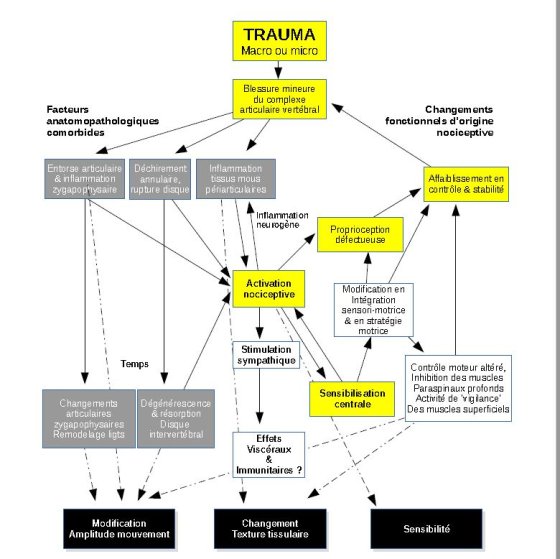
Le dysfonctionnement est vraisemblablement déclenché par une lésion tissulaire, soit un macroscopisme, soit un micro-traumatisme répété. Une lésion de la capsule articulaire, des tissus mous périarticulaires ou de l’anneau du disque provoquera une inflammation et activera les nocicepteurs. Les lésions et l’activation des nocicepteurs peuvent ou non impliquer une conscience consciente de la douleur car la douleur est une production du cerveau et modifiée par de nombreux facteurs (49,57). L’activation des nocicepteurs et des voies nociceptives peut produire des réflexes radiculaires dorsaux favorisant l’inflammation des tissus neurogéniques. Cette pulsion nociceptive peut altérer l’activité motrice des muscles apparentés (65,66,67), inhibant très probablement l’activité de la musculature segmentaire profonde tout en augmentant l’activation de la musculature superficielle et multi-segmentaire (36,37). Si la douleur est présente, une surveillance volontaire et involontaire du comportement peut encore augmenter la sortie du moteur.
La pulsion nociceptive peut également produire une excitation sympathique et, à long terme, avoir un impact négatif sur la fonction viscérale et immunitaire (7,46). Les modèles traditionnels de dysfonctionnement somatique proposent que les réflexes neuraux segmentaux « ascendants » produisent des changements somato-viscéraux (7,39,40), mais il est plus probable que l’expérience de la douleur influence les centres supérieurs pour produire des réactions de stress généralisées et un éveil autonome qui entraînent des conséquences à long terme sur la santé (44,68). La douleur aiguë augmente l’activité sympathique et la tension artérielle. de la douleur chronique sont plus complexes, la douleur chronique est également associée à la pulsion sympathique et à l’hypertension.
En présence de douleur, la proprioception et le contrôle moteur deviennent altérés (65,66,67,70,71,72,73,74,75,76), laissant potentiellement le segment et la région plus vulnérables à d’autres blessures. Le mal de dos semble modifier la stratégie motrice pour protéger et décharger la structure blessée, inhiber l’activation des muscles spinaux profonds et augmenter l’activation de la musculature lombaire superficielle (36,37,77). Ces changements peuvent affecter le contrôle moteur fin de la région. Les patients souffrant de douleurs cervicales chroniques ont un mouvement cervical saccadé et irrégulier (70) et une acuité de positionnement plus faible que les témoins sains (70,71,72,73). Les patients souffrant de douleurs au cou démontrent également une plus grande mobilité posturale (74,75,76). Les preuves suggèrent que la douleur affecte le cerveau moteur, réduisant le volume de la carte des muscles dans le cortex moteur primaire et « maculant » la représentation musculaire des différents muscles du cortex (65,66,67). Ainsi, les voies nociceptives activées et l’expérience de la douleur sont susceptibles de provoquer une plus faible acuité de position, un contrôle moteur et une stabilité du segment douloureux ou de la région du corps et de prédisposer à d’autres blessures.
Au fil du temps et avec des efforts et blessures répétés, des changements dégénératifs peuvent survenir au disque et aux articulations zygapophysaires, et même si le rôle de la génétique peut être plus important que le chargement et le mode de vie dans la dégénérescence discale (78,79). La modification dégénérative du complexe articulaire de la colonne vertébrale entraînera probablement un changement de mouvement segmentaire à long terme, soit une hypermobilité, soit une hypomobilité.
Bien que les praticiens ostéopathes ne puissent pas distinguer les causes sous-jacentes des signes cliniques qu’ils palpent, ce modèle conceptuel (Figure 1) peut être utile pour guider le raisonnement clinique du praticien en considérant les processus sous-jacents probables associés aux signes palpables de dysfonctionnement. Les ostéopathes doivent également être conscients que tous ces facteurs ne peuvent pas faire l’objet d’un traitement manuel.
VI - Dysfonction...
VI - Dysfonction somatique : pertinence pour la profession moderne
Bien que le concept de dysfonctionnement somatique soit considéré par de nombreux ostéopathes comme un élément central de la pratique de l’ostéopathie (4), d’autres le considèrent comme un concept anachronique qui menace de ridiculiser la profession, tout comme la subluxation chiropratique discréditée (81). une maladie classifiable internationale (CIM) avec l’Organisation mondiale de la santé (sous « M 99 lésions biomécaniques, non classés ailleurs ») (82), le terme dysfonctionnement somatique est vague et n’a pas de physiopathologie définie. La classification CIM sert très probablement les intérêts des médecins ostéopathes des États-Unis qui utilisent les numéros d’article à des fins de facturation et de remboursement, mais la classification est peu pertinente pour les ostéopathes en dehors des États-Unis ou pour les membres d’autres professions.
En outre, cet auteur suggère que l’utilisation du terme « dysfonctionnement somatique » a peu de signification clinique à des fins de diagnostic, étant donné son manque de spécificité et la probabilité que différents processus produisent ces signaux palpatoires. Parce que le terme est vague et manque d’une physiopathologie claire, il est peu utile de communiquer la présence d’un dysfonctionnement somatique chez les autres ostéopathes lorsque des descripteurs plus précis, tels que le mouvement restreint ou la sensibilité, peuvent être utilisés. Il serait encore moins utile de déclarer la présence d’un dysfonctionnement somatique à des praticiens d’autres professions, étant donné que le terme est rarement utilisé ou compris en dehors de la profession. Malgré cela, l’auteur est au courant des praticiens privés et des praticiens dans les cliniques d’enseignement qui utilisent ce terme dans un diagnostic écrit.
L’auteur a tenté dans des articles précédents de fournir une explication plausible des phénomènes cliniques attribués au dysfonctionnement somatique, en tenant compte à la fois des changements fonctionnels et des comorbidités tissulaires (8,9), et a fourni un modèle mis à jour dans cet article. Étant donné que le modèle met l’accent sur les signes physiques palpables, les facteurs considérés dans ce modèle sont en grande partie biomédicaux, mais l’auteur ne veut pas laisser entendre que les praticiens ne devraient considérer que les facteurs biomédicaux dans la gestion des patients. La prise en charge des patients doit tenir compte des facteurs tissulaires, neurologiques et biopsychosociaux
A - Fiabilité et validité du diagnostic
Lorsque l’on considère la signification clinique du terme dysfonctionnement somatique, la fiabilité et la validité du diagnostic doivent être prises en compte. Pour qu’un test clinique soit utile, il doit être fiable lorsque des mesures répétées effectuées par des examinateurs identiques ou différents donnent le même résultat et sont valables lorsque le test mesure ce qu’il est censé mesurer (83) La fiabilité diagnostique de bon nombre des indices de dysfonction somatique sont faibles (84,85,86). La palpation de la sensibilité a une fiabilité inter-examinateur acceptable, mais la fiabilité de la palpation de la restriction de mouvement segmentaire ou des modifications de la texture tissulaire est généralement médiocre (84,85,86), les repères sont passables à mauvais (87), sauf s’il existe une asymétrie substantielle (88).
Les données suggèrent que la formation consensuelle peut considérablement améliorer la fiabilité de ces résultats entre praticiens (89,90), bien que la validité de ces résultats de consensus reste encore à explorer. D’autres études ont trouvé une amélioration de la fiabilité lors de l’utilisation d’une combinaison de tests diagnostiques pour détecter les articulations symptomatiques, à condition que la provocation soit l’un des tests (91,92,93,94). Cependant, ces tests peuvent simplement localiser une articulation symptomatique ou une région d’hyperalgésie , ce qui n’est pas nécessairement analogue au dysfonctionnement somatique.
De plus, la pertinence du dysfonctionnement somatique par rapport à l’état de santé ou à la maladie n’est pas établie. La validité de l’asymétrie posturale et structurelle en tant qu’indicateurs de dysfonctionnement est douteuse, étant donné le manque d’association avec de tels résultats et maux de dos.95 Quelques chercheurs ont tenté de relier les résultats palpatoires de dysfonctionnement somatique aux conditions des patients (96,97) pour détecter la plupart des indices cliniques sape la crédibilité de toutes les associations rapportées. Le manque de fiabilité pour la détection et le manque de validité pour l’association avec la douleur ou la maladie de ces signes cliniques mine l’affirmation ostéopathique traditionnelle que le dysfonctionnement somatique est important dans la santé et la maladie.
B - Confondeurs pour le diagnostic palpatoire
Le concept ostéopathique du dysfonctionnement somatique est basé sur des modèles biomédicaux et biomécaniques, où les résultats cliniques physiques signalent une anomalie fonctionnelle et un traitement manipulatif ultérieur normalise la fonction. En plus de la fiabilité médiocre du diagnostic, la science de la douleur confond davantage la croyance que la palpation identifie une base tissulaire pour un dysfonctionnement. On pense généralement que la palpation de la tendreté tissulaire et les changements de texture impliquent les tissus sous-jacents, mais la sensibilité du tissu normal peut être provoquée par l’allodynie et la sensibilisation du SNC et le changement de texture peuvent être produits dans le tissu normal de l’inflammation neurogène chez certains individus. Les ostéopathes doivent donc être conscients des signes de sensibilisation centrale, tels que la douleur généralisée et l’hyperalgésie, la chronicité des symptômes et l’intolérance à divers stimuli, afin de mieux interpréter la pertinence de leurs constatations cliniques (52). Ce modèle conceptuel proposé (Fig. 1), avec une bonne connaissance de la science de la douleur et des signes de sensibilisation centrale, peut aider le raisonnement clinique et l’interprétation des résultats physiques.
C - Le langage du dysfonctionnement
Le langage médical utilisé avec les patients peut avoir une grande influence sur l’appréciation de leur condition par le patient. La communication peut être rassurante et habilitante ou peut être déresponsabilisante et renforcer le comportement d’évitement de la peur et la catastrophisation chez les patients. Au cours des dernières décennies, il a été suggéré que les facteurs biopsychosociaux chez les patients, tels que leur compréhension (ou malentendu) de leur condition et les comportements résultants à la douleur, ont une forte influence sur l’évolution et le pronostic de la douleur et de l’incapacité (98,99).
Historiquement, le traitement manipulatif ostéopathique a été développé dans un cadre conceptuel biomécanique et a donné lieu à une gamme disparate d’étiquettes pour les dysfonctionnements présumés. L’utilisation d’une terminologie jargonneuse peut être déresponsabilisante pour de nombreux patients car des dysfonctionnements essentiellement bénins (typiquement des troubles mineurs du mouvement) peuvent être interprétés comme des déficiences graves avec des conséquences à long terme et nécessitant un traitement manuel passif continu pour la correction.
Le langage associé au modèle biomécanique de Fryette des années 1950 (64), un modèle communément enseigné aux États-Unis et en Europe, utilise généralement des étiquettes « positionnelles » complexes pour décrire la dysfonction segmentaire. Ce modèle est encore utilisé dans de nombreux textes ostéopathiques courants (1,5,27,100), même s’il a été largement discrédité (101,102,103,104,105). Même si ces termes sont qualifiés de restriction de mouvement ou de préférence de mouvement positions (1), les étiquettes positionnelles de dysfonctionnement qui incluent des vertèbres « fléchies et tournées », des os innominés « antérieurement tournés », ou des premières côtes « subluxées supérieures » impliquent inévitablement le concept erroné d’un « os déplacé ». L’utilisation d’un tel langage peut confirmer l’impression d’un trouble structurel grave dans l’esprit d’un patient craintif et souffrant, conduisant à un comportement catastrophique, à l’évitement de la peur et à une dépendance inutile au traitement.
De l’avis de cet auteur, la terminologie positionnelle est anachronique et potentiellement nuisible. La terminologie de restriction de mouvement est un moyen préférable de définir les caractéristiques de mouvement d’un segment parce qu’elle ne renforce pas le message d’un déplacement fixe dans l’esprit du patient ou du praticien. Même l’utilisation du terme « dysfonctionnement somatique » peut transmettre un message similaire au patient à moins qu’il ne soit déconstruit et démystifié. Ce terme a sans doute peu de sens pour décrire les caractéristiques de dysfonctionnement à d’autres ostéopathes, et encore moins aux patients, de sorte que l’utilisation du terme est mieux limitée à la considération théorique de la nature du dysfonctionnement et des causes des signes palpatoires.
À l’heure actuelle, nous savons peu de choses à quelle fréquence le terme « dysfonctionnement somatique » est utilisé, quelle importance les ostéopathes y accordent et quels messages les ostéopathes transmettent à leurs patients au sujet de leurs constatations physiques et de leur diagnostic. Il est probable que l’utilisation de ce terme dans la profession varie grandement à travers le monde. Par conséquent, la profession ostéopathique internationale a besoin d’examiner, de discuter et de faire des recherches sur ce sujet de manière collaborative afin d’offrir un message cohésif (cohérent ?) fondé sur des données probantes à ce sujet.
VII - Conclusion
Un modèle conceptuel a été présenté qui décrit les causes plausibles des indices diagnostiques palpatoires communément attribués au dysfonctionnement somatique intervertébral. Ce modèle aidera le raisonnement clinique du praticien lors de l’interprétation des résultats palpatoires. La dysfonction somatique n’a pas été présentée comme une entité clinique unique, mais comme de nombreux facteurs tissulaires neurologiques et comorbides impliqués dans un cycle de lésion mineure, un changement dégénératif et les conséquences nociceptives et neurologiques résultantes. La palpation seule ne peut pas différencier les causes sous-jacentes des signes cliniques de dysfonctionnement, de sorte que ces signes doivent être interprétés dans le contexte des antécédents, des blessures, de la chronicité et des signes de sensibilisation.
Le dysfonctionnement somatique est un concept qui est considéré comme essentiel à la philosophie ostéopathique par beaucoup dans la profession. Cependant, étant donné le manque de spécificité du terme, la probabilité que de nombreux facteurs contribuent aux signes cliniques, le manque de fiabilité pour détecter la plupart des caractéristiques cliniques, et la perte de pouvoir qui peut accompagner l’utilisation des étiquettes du jargon médical, il a été soutenu que ce terme n’a aucune utilité clinique à des fins diagnostiques ou pour communiquer un diagnostic à des patients ou à d’autres praticiens. Ainsi, bien que le concept puisse être utile comme modèle pour interpréter les signes diagnostiques palpatoires et faciliter le raisonnement clinique pour un traitement manipulateur, son utilisation comme étiquette de diagnostic dans le cadre de la pratique devrait être abandonnée. Il existe un besoin continu d’étudier les concepts théoriques ostéopathiques et de réfléchir sur les preuves disponibles. L’auteur recommande donc à la profession internationale d’examiner, de réfléchir et de discuter de cette question du dysfonctionnement somatique de manière réfléchie et collaborative.
Remerciements
L’auteur tient à remercier Deborah Goggin, MA, Scientific Writer, A.T. Still University, dans la préparation de ce manuscrit pour publication.
Reférences
1. Greenman, P.E. Principles of manual medicine. 3rd ed. Lippincott William & Wilkins, Philadelphia ; 2003.
2. Dove, C.A. History of the osteopathic vertebral lesion. Br Osteopath J. 1967 ; : 3
3. Educational Council on Osteopathic Principles. Glossary of osteopathic terminology : American association of colleges of osteopathic medicine. ([accessed on 29.09.15]) ; 2011
http://www.aacom.org/news-and-events/publications/glossary-of-osteopathic-terminology
4. Patterson, M.M. and Wurster, R.D. Somatic dysfunction, spinal facilitation, and viscerosomatic integration. in : A.G. Chila (Ed.) Foundations of osteopathic medicine. 3rd ed. Lippincott William & Wilkins, Philadelphia, PA ; 2011 : 118–133
5. DiGiovanna, E.L., Schiowitz, S., and Dowling, D.J. An osteopathic approach to diagnosis & treatment. 3rd ed. Lippincott William & Wilkins, Philadelphia ; 2005
6. Fryer, G., Morris, T., and Gibbons, P. The relationship between palpation of thoracic paraspinal tissues and pressure sensitivity measured by a digital algometer. J Osteopath Med. 2004 ; 7 : 64–69 -
7. Korr, I.M. Clinical significance of the facilitated state. J Am Osteopath Assoc. 1954 ; 54 : 277–282
8. Fryer, G. Somatic dysfunction : updating the concept. Aust J Osteopath. 1999 ; 10 : 14–19 [Voir : http://vuir.vu.edu.au/505/3/img-912122725-0001.pdf
9. Fryer, G. Intervertebral dysfunction : a discussion of the manipulable spinal lesion. J Osteopath Med. 2003 ; 6 : 64–73
10. Gibbons, P. and Tehan, P. The intervertebral lesion : a professional challenge. Br Osteopath J. 2000 ; 22 : 11–16
11. Fryer, G. and Fossum, C. Therapeutic mechanisms underlying muscle energy approaches. in : C. Fernández-de-las-Peñas, L. Arendt-Nielsen, R.D. Gerwin (Eds.) Tension-type and cervicogenic headache : pathophysiology, diagnosis, and management. Jones and Bartlett Publishers, Sudbury, MA ; 2010 : 221–229
12. Gibbons, P. and Tehan, P. Manipulation of the spine, thorax and pelvis. An osteopathic perspective. 3rd ed. Churchill Livingstone, London ; 2008
13. Ehrenfeuchter, W.C. and Kappler, R.E. Palpatory examination. Foundations of osteopathic medicine. 3rd ed. Lippincott Williams & Wilkins, Philadelphia, PA ; 2011 : 401–409
14. Kimberly, P.E. The Kimberly manual. Outline of osteopathic manipulative procedures. 2006 ed. Walsworth Publishing, Marceline ; 2006
15. Stoddard, A. Manual of osteopathic practice. Hutchinson & Co, London ; 1969
16. Bogduk, N. Clinical anatomy of the lumbar spine and sacrum. 4th ed. Churchill Livingstone, New York ; 2005
17. Beresford, Z.M., Kendall, R.W., and Willick, S.E. Lumbar facet syndromes. Curr Sports Med Rep. 2010 ; 9 : 50–56.
18. Nazarian, L.N., Zegel, H.G., Gilbert, K.R., Edell, S.L., Bakst, B.L., and Goldberg, B.B. Paraspinal ultrasonography : lack of accuracy in evaluating patients with cervical or lumbar back pain. J Ultrasound Med. 1998 ; 17 : 117–122.
19. Fryer, G. and Adams, J.H. Magnetic resonance imaging of subjects with acute unilateral neck pain and restricted motion : a prospective case series. Spine J. 2011 ; 11 : 171–176.
20. Webb, A.L., Collins, P., Rassoulian, H., and Mitchell, B.S. Synovial folds – a pain in the neck ?. Man Ther. 2011 ; 16 : 118–124
21. Gatterman, M.I. Foundations of chiropractic : subluxation. 2nd ed. Elsevier Mosby, St Louis ; 2005
22. Cramer, G.D., Henderson, C.N., Little, J.W., Daley, C., and Grieve, T.J. Zygapophyseal joint adhesions after induced hypomobility. J Manipulative Physiol Ther. 2010 ; 33 : 508–518
23. Steilen, D., Hauser, R., Woldin, B., and Sawyer, S. Chronic neck pain : making the connection between capsular ligament laxity and cervical instability. Open Orthop J. 2014 ; 8 : 326–345 -
24. Nadeau, M., McLachlin, S.D., Bailey, S.I., Gurr, K.R., Dunning, C.E., and Bailey, C.S. A biomechanical assessment of soft-tissue damage in the cervical spine following a unilateral facet injury. J Bone Joint Surg. 2012 ; 94 : e156
25. Frank, C.B., Hart, D.A., and Shrive, N.G. Molecular biology and biomechanics of normal and healing ligaments–a review. Osteoarthritis Cartilage. 1999 ; 7 : 130–140
26. Jung, H.-J., Fisher, M.B., and Woo, S.L.Y. Role of biomechanics in the understanding of normal, injured, and healing ligaments and tendons. Sports Med Arthrosc Rehabil Ther Technol. 2009 ; 1 : 9
27. Ehrenfeuchter, W.C. Segmental motion testing. in : A.G. Chila (Ed.) Foundations of osteopathic medicine. 3rd ed. Lippincott William & Wilkins, Philadelphia, PA ; 2011 : 431–436
28. Bogduk, N., Aprill, C., and Derby, R. Lumbar discogenic pain : state-of-the-art review. Pain Med. 2013 ; 14 : 813–836
29. Cyriax, J. Textbook of orthopaedic medicine. vol. 1. 7th ed. Balliere Tindall, London ; 1978
30. McKenzie, R.A. The lumbar spine. Mechanical diagnosis and therapy. Spinal Publications, Wellington ; 1981
31. Brinjikji, W., Luetmer, P.H., Comstock, B., Bresnahan, B.W., Chen, L.E., Deyo, R.A. et al. Systematic literature review of imaging features of spinal degeneration in asymptomatic populations. Am J Neuroradiol. 2015 ; 36 : 811–816
32. Nakashima, H., Yukawa, Y., Suda, K., Yamagata, M., Ueta, T., and Kato, F. Abnormal findings on magnetic resonance images of the cervical spines in 1211 asymptomatic subjects. Spine (Phila Pa 1976). 2015 ; 40 : 392–398
33. Ellingson, A.M., Shaw, M.N., Giambini, H., and An, K.N. Comparative role of disc degeneration and ligament failure on functional mechanics of the lumbar spine. Comput Methods Biomech Biomed Engin. 2015 ; : 1–10
34. Colloca, C.J., Keller, T.S., Moore, R.J., Gunzburg, R., and Harrison, D.E. Intervertebral disc degeneration reduces vertebral motion responses. Spine (Phila Pa 1976). 2007 ; 32 : E544–E550
35. Indahl, A., Kaigle, A., Reikeras, O., and Holm, S. Electromyographic response of the porcine multifidus musculature after nerve stimulation. Spine (Phila Pa 1976). 1995 ; 20 : 2652–2658
36. Fryer, G., Morris, T., and Gibbons, P. Paraspinal muscles and intervertebral dysfunction. Part 1. J Manipulative Physiol Ther. 2004 ; 27 : 267–274
37. Fryer, G., Morris, T., and Gibbons, P. Paraspinal muscles and intervertebral dysfunction. Part 2. J Manipulative Physiol Ther. 2004 ; 27 : 348–357
38. Fryer, G., Bird, M., Robbins, B., and Johnson, J. Resting electromyographic activity of deep thoracic transversospinalis muscles identified as abnormal with palpation. J Am Osteopath Assoc. 2010 ; 110 : 61–68
39. Korr, I.M. The neural basis of the osteopathic lesion. J Am Osteopath Assoc. 1947 ; 47 : 191–198
40. Korr, I.M. Proprioceptors and somatic dysfunction. J Am Osteopath Assoc. 1975 ; 75 : 638–650
41. Denslow, J.S. and Clough, G.H. Reflex activity in the spinal extensors. J Neurophysiol. 1941 ; 4 : 430–437
42. Denslow, J.S., Korr, I.M., and Krems, A.D. Quantitative studies of chronic facilitation in human motorneuron pools. Am J Physiol. 1947 ; 150 : 229–238
43. Korr, I.M., Wright, H.M., and Thomas, P.E. Effects of experimental myofascial insults on cutaneous patterns of sympathetic activity in man. J Neural Transm. 1962 ; 23 : 330–355
44. Lederman, E. Facilitated segments : a critical review. Br Osteopath J. 2000 ; 22 : 7–10
45. Franke, H. Research and osteopathy : an interview with Dr Gary Fryer. J Bodyw Mov Ther. 2010 ; 14 : 304–308
46. Van Buskirk, R.L. Nociceptive reflexes and the somatic dysfunction : a model. (797–809)J Am Osteopath Assoc. 1990 ; 90 : 792–794
47. Fryer, G., Bird, M., Robbins, B., and Johnson, J.C. Electromyographic responses of deep thoracic transversospinalis muscles to osteopathic manipulative interventions. Int J Osteopath Med. 2013 ; 16 : e3–e4
48. Woolf, C.J. What to call the amplification of nociceptive signals in the central nervous system that contribute to widespread pain ?. Pain. 2014 ; 155 : 1911–1912
49. Woolf, C.J. Central sensitization : implications for the diagnosis and treatment of pain. Pain. 2011 ; 152 : S2–S15
50. Latremoliere, A. and Woolf, C.J. Central sensitization : a generator of pain hypersensitivity by central neural plasticity. J Pain. 2009 ; 10 : 895–926
51. Quinn, K.P., Dong, L., Golder, F.J., and Winkelstein, B.A. Neuronal hyperexcitability in the dorsal horn after painful facet joint injury. Pain. 2010 ; 151 : 414–421
52. Nijs, J., Van Houdenhove, B., and Oostendorp, R.A.B. Recognition of central sensitization in patients with musculoskeletal pain : application of pain neurophysiology in manual therapy practice. Man Ther. 2010 ; 15 : 135–141
53. Steinhoff, M., Stander, S., Seeliger, S., Ansel, J.C., Schmelz, M., and Luger, T. Modern aspects of cutaneous neurogenic inflammation. Arch Dermatol. 2003 ; 139 : 1479–1488
54. Willis, W.D. Jr. Dorsal root potentials and dorsal root reflexes : a double-edged sword. Exp Brain Res. 1999 ; 124 : 395–421
55. Sluka, K.A., Rees, H., Westlund, K.N., and Willis, W.D. Fiber types contributing to dorsal root reflexes induced by joint inflammation in cats and monkeys. J Neurophysiol. 1995 ; 74 : 981–989
56. Rees, H., Sluka, K.A., Lu, Y., Westlund, K.N., and Willis, W.D. Dorsal root reflexes in articular afferents occur bilaterally in a chronic model of arthritis in rats. J Neurophysiol. 1996 ; 76 : 4190–4193
57. Willard, F., Jerome, J.A., and Mitchell, L.E. Nociception and pain : the essence of pain lies mainly in the brain. in : A.G. Chila (Ed.) Foundations of osteopathic medicine. 3rd ed. Lippincott William & Wilkins, Philadelphia, PA ; 2011 : 228–252
58. Bo Peng, Y., Kenshalo, D.R., and Gracely, R.H. Periaqueductal gray-evoked dorsal root reflex is frequency dependent. Brain Res. 2003 ; 976 : 217–226
59. Wallwork, T.L., Stanton, W.R., Freke, M., and Hides, J.A. The effect of chronic low back pain on size and contraction of the lumbar multifidus muscle. Man Ther. 2009 ; 14 : 496–500
60. Hides, J.A., Richardson, C.A., and Jull, G.A. Magnetic resonance imaging and ultrasonography of the lumbar multifidus muscle. Spine. 1995 ; 20 : 54–58
61 Hides, J., Gilmore, C., Stanton, W., and Bohlscheid, E. Multifidus size and symmetry among chronic LBP and healthy asymptomatic subjects. Man Ther. 2008 ; 13 : 43–49
62. Fortin, M. and Macedo, L.G. Multifidus and paraspinal muscle group cross-sectional areas of patients with low back pain and control patients : a systematic review with a focus on blinding. Phys Ther. 2013 ; 93 : 873–888
63. Fryer, G., Morris, T., and Gibbons, P. The relationship between palpation of thoracic tissues and deep paraspinal muscle thickness. Int J Osteopath Med. 2005 ; 8 : 22–28
64. Fryette, H.H. Principles of osteopathic technic. American Academy of Osteopathy, Newark, OH ; 1954
65. Schabrun, S.M., Elgueta-Cancino, E.L., and Hodges, P.W. Smudging of the motor cortex is related to the severity of low back pain. Spine (Phila Pa 1976). 2015 ; http://dx.doi.org/10.1097/BRS.0000000000000938
66. Tsao, H., Danneels, L.A., and Hodges, P.W. ISSLS prize winner : smudging the motor brain in young adults with recurrent low back pain. Spine (Phila Pa 1976). 2011 ; 36 : 1721–1727
67. Schabrun, S.M., Hodges, P.W., Vicenzino, B., Jones, E., and Chipchase, L.S. Novel adaptations in motor cortical maps : the relation to persistent elbow pain. Med Sci Sports Exerc. 2015 ; 47 : 681–690
68. Lederman, E. The science and practice of manual therapy. 2nd ed. Elsevier Churchill Livingstone, Edinburgh ; 2005
69. Saccò, M., Meschi, M., Regolisti, G., Detrenis, S., Bianchi, L., Bertorelli, M. et al. The relationship between blood pressure and pain. J Clin Hypertens. 2013 ; 15 : 600–605
70. Sjolander, P., Michaelson, P., Jaric, S., and Djupsjobacka, M. Sensorimotor disturbances in chronic neck pain : range of motion, peak velocity, smoothness of movement, and repositioning acuity. Man Ther. 2008 ; 13 : 122–131
71. Grip, H., Sundelin, G., Gerdle, B., and Karlsson, J.S. Variations in the axis of motion during head repositioning : a comparison of subjects with whiplash-associated disorders or non-specific neck pain and healthy controls. Clin Biomech (Bristol, Avon). 2007 ; 22 : 865–873
72. Lee, H.Y., Wang, J.D., Yao, G., and Wang, S.F. Association between cervicocephalic kinesthetic sensibility and frequency of subclinical neck pain. Man Ther. 2008 ; 13 : 419–425
73. de Vries, J., Ischebeck, B.K., Voogt, L.P. et al. Joint position sense error in people with neck pain : a systematic review. Man Ther. 2015 ; 20 : 736–744
74. Ruhe, A., Fejer, R., and Walker, B. Altered postural sway in patients suffering from non-specific neck pain and whiplash associated disorder – a systematic review of the literature. Chiropr Man Ther. 2011 ; 19 : 13
75. Mazaheri, M., Coenen, P., Parnianpour, M., Kiers, H., and van Dieën, J.H. Low back pain and postural sway during quiet standing with and without sensory manipulation : a systematic review. Gait Posture. 2013 ; 37 : 12–22
76. Ruhe, A., Fejer, R., and Walker, B. Center of pressure excursion as a measure of balance performance in patients with non-specific low back pain compared to healthy controls : a systematic review of the literature. Eur Spine J. 2011 ; 20 : 358–368 -
77. Zedka, M., Prochazka, A., Knight, B., Gillard, D., and Gauthier, M. Voluntary and reflex control of human back muscles during induced pain. J Physiol. 1999 ; 520 : 591–604
78. Videman, T., Battie, M.C., Ripatti, S., Gill, K., Manninen, H., and Kaprio, J. Determinants of the progression in lumbar degeneration : a 5-year follow-up study of adult male monozygotic twins. Spine (Phila Pa 1976). 2006 ; 31 : 671–678
79. Videman, T., Battie, M.C., Parent, E., Gibbons, L.E., Vainio, P., and Kaprio, J. Progression and determinants of quantitative magnetic resonance imaging measures of lumbar disc degeneration : a five-year follow-up of adult male monozygotic twins. Spine (Phila Pa 1976). 2008 ; 33 : 1484–1490
80. Bogduk, N. Degenerative joint disease of the spine. Radiol Clin North Am. 2012 ; 50 : 613–628
81. Young, M. Humpty dumpty chiropractic. Clin Chiropr. 2010 ; 13 : 197–198
82. World Health Organisation. International classification of diseases (ICD). Available at : http://apps.who.int/classifications/icd10/browse/2016/en#/M99. [accessed 2.10.15].
83. Lucas, N. and Bogduk, N. Diagnostic reliability in osteopathic medicine. Int J Osteopath Med. 2011 ; 14 : 43–47
84. Seffinger, M.A., Najm, W.I., Mishra, S.I., Adams, A., Dickerson, V.M., Murphy, L.S. et al. Reliability of spinal palpation for diagnosis of back and neck pain : a systematic review of the literature. Spine (Phila Pa 1976). 2004 ; 29 : E413–E425
85. Triano, J.J., Budgell, B., Bagnulo, A., Roffey, B., Bergmann, T., Cooperstein, R. et al. Review of methods used by chiropractors to determine the site for applying manipulation. Chiropr Man Ther. 2013 ; 21 : 36
86. Stochkendahl, M.J., Christensen, H.W., Hartvigsen, J., Vach, W., Haas, M., Hestbaek, L. et al. Manual examination of the spine : a systematic critical literature review of reproducibility. J Manipulative Physiol Ther. 2006 ; 29 : 475–485
87. Haneline, M.T. and Young, M. A review of intraexaminer and interexaminer reliability of static spinal palpation : a literature synthesis. J Manipulative Physiol Ther. 2009 ; 32 : 379–386
88. Fryer, G. Factors affecting the intra-examiner and inter-examiner reliability of palpation for supine medial malleoli asymmetry. Int J Osteopath Med. 2006 ; 9 : 58–65 -
89. Degenhardt, B.F., Johnson, J.C., Snider, K.T., and Snider, E.J. Maintenance and improvement of interobserver reliability of osteopathic palpatory tests over a 4-month period. J Am Osteopath Assoc. 2010 ; 110 : 579–586
90. Degenhardt, B.F., Snider, K.T., Snider, E.J., and Johnson, J.C. Interobserver reliability of osteopathic palpatory diagnostic tests of the lumbar spine : improvements from consensus training. J Am Osteopath Assoc. 2005 ; 105 : 465–473
91. Jull, G., Zito, G., Trott, P., Potter, H., and Shirley, D. Inter-examiner reliability to detect painful upper cervical joint dysfunction. Aust J Physiother. 1997 ; 43 : 125–129
92. Jull, G.A., Bogduk, N., and Marsland, A. The accuracy of manual diagnosis for cervical zygapophysial joint pain syndromes. Med J Aust. 1988 ; 148 : 233–236
93. Jull, G.A., Treleaven, J., and Versace, G. Manual examination : is pain provocation a major cue for spinal dysfunction ?. Aust J Physiother. 1994 ; 40 : 159–165 - Abstract - Full Text PDF - PubMed - Scopus (45)
94. Phillips, D.R. and Twomey, L.T. A comparison of manual diagnosis with a diagnosis established by a uni-level lumbar spinal block procedure. Man Ther. 1996 ; 2 : 82–87
95. Lederman, E. The fall of the postural-structural-biomechanical model in manual and physical therapies : exemplified by lower back pain. J Bodyw Mov Ther. 2011 ; 15 : 131–138
96. Licciardone, J.C., Fulda, K.G., Stoll, S.T., Gamber, R.G., and Cage, A.C. A case-control study of osteopathic palpatory findings in type 2 diabetes mellitus. Osteopath Med Prim Care. 2007 ; 1 : 1–12
97. Licciardone, J.C., Kearns, C.M., Hodge, L.M., and Minotti, D.E. Osteopathic manual treatment in patients with diabetes mellitus and comorbid chronic low back pain : subgroup results from the OSTEOPATHIC Trial. J Am Osteopath Assoc. 2013 ; 113 : 468–478
98. Kamper, S.J., Apeldoorn, A.T., Chiarotto, A., Smeets, R.J., Ostelo, R.W., Guzman, J. et al. Multidisciplinary biopsychosocial rehabilitation for chronic low back pain. Cochrane Database Syst Rev. 2014 ; 9 : CD000963
99. Pincus, T., Kent, P., Bronfort, G., Loisel, P., Pransky, G., and Hartvigsen, J. Twenty-five years with the biopsychosocial model of low back pain-is it time to celebrate ? A report from the twelfth international forum for primary care research on low back pain. Spine (Phila Pa 1976). 2013 ; 38 : 2118–2123
100. Mitchell, F.L. Jr. and Mitchell, P.K.G. The muscle energy manual. vol. 1. MET Press, East Lansing, Michigan ; 1995
101. Fryer, G. Muscle energy technique : an evidence-informed approach. Int J Osteopath Med. 2011 ; 14 : 3–9
102. Cook, C., Sizer, P. Jr., Brismee, J.M., Showalter, C., and Huijbregts, P. Does evidence support the existence of lumbar spine coupled motion ? A critical review of the literature. J Orthop Sports Phys Ther. 2007 ; 37 : 412
103. Gibbons, P. and Tehan, P. Muscle energy concepts and coupled motion of the spine. Man Ther. 1998 ; 3 : 95–101
104. Legaspi, O. and Edmond, S.L. Does the evidence support the existence of lumbar spine coupled motion ? A critical review of the literature. J Orthop Sports Phys Ther. 2007 ; 37 : 169–178
105. Malmstrom, E., Karlberg, M., Fransson, P.A., Melander, A., and Magnusson, M. Primary and coupled cervical movements. The effect of age, gender, and body mass index. A 3-dimensional movement analysis of a population without symptoms of neck disorders. Spine. 2006 ; 31 : E44–E50